Salvamento, Fusión, Amputación
de Prótesis de Rodilla Infectada.
DR. MANUEL VILLANUEVA
Salvamento, fusión y amputación
para tratar la infección de prótesis de rodilla.
La artrodesis o fusión de la articulación, la artroplastia resección y la amputación por infección de prótesis de rodilla son tratamientos raros en nuestros días pero aún necesarios en una minoría de pacientes. De ellos hablaremos en este capítulo.
Las opciones o alternativas para curar y tratar una infección de prótesis articular de rodilla hemos comentado en nuestro artículo de infección de prótesis de rodilla que eran:
☑️ Tratamiento de la infección de prótesis de rodilla con retención del implante (sin quitar la prótesis).
a. Tratamiento supresor sin desbridamiento
b. Desbridamiento con retención de implante, incluyendo recambio parcial del implante
☑️ Tratamiento de la infección de prótesis de rodilla con retirada y recambio del implante.
a. En 1 tiempo
b. En 2 tiempos
☑️ Terapias de salvamento, fusión o artrodesis, artroplastia resección o amputación. Se tratarán:
a. Artrodesis de rodilla. Que consiste en dejar la rodilla rígida
b. Amputación. En situaciones extremas y ante el fracaso del resto de alternativas
El médico debe informar verazmente al paciente sobre la posibilidad de realizar estas opciones quirúrgicas en el caso de que fracasen las formas de tratamiento descritas anteriormente.
La fusión (dejar la articulación rígida) es el principal procedimiento de salvamento en prótesis total de rodilla infectada y en prótesis total de cadera es la artroplastia resección (dejar la articulación sin prótesis), que deja una articulación indolora en el 80% de los casos.
IR A:
¿Cuándo está indicados los tratamientos de salvamento en las prótesis de rodillas infectadas?
☑️ Indicaciones de fusión de rodilla
-Mecanismo extensor destruido o Cobertura cutánea limitada
-Múltiples organismos, Inmunodeficiencia
Clavo intramedular es el procedimiento de elección, con un 85-90% éxitos
-No garantiza la erradicación de la infección;
-Riesgo de sepsis y osteomielitis si no está curada la infección previamente
☑️ Indicaciones de artroplastia resección de rodilla
-Fragilidad médica del paciente o aparición de una complicación médica durante la fase de resección o antibioticoterapia
-En la prótesis de rodilla puede ser una alternativa para rescate de una artrodesis
-Pacientes que no deambulaban previamente o con afectación multiarticular
☑️ Indicación de amputación
-Toxicidad sistémica o sepsis con amenaza vital
-Infecciones refractarias al tratamiento (polimicrobianas, virulentas)
-Intensa pérdida ósea o tisular (MI Fláccido, inválido) o dolor intratable
-Compromiso neurovascular
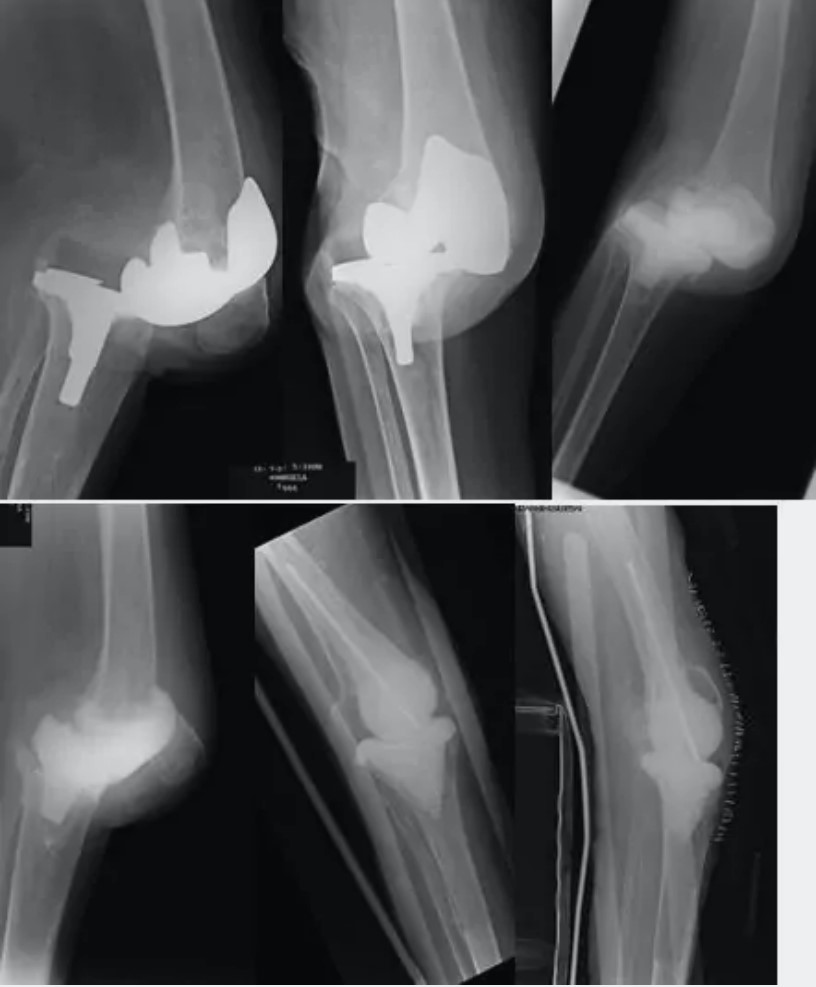
Paciente con Artritis reumatoide, DM, infección polimicrobiana. Luxación de prótesis primaria. Luxación de espaciador preconformado con daño del mecanismo extensor. Espaciador “ball and socket” con cemento con triple antibiótico para ganar estabilidad y erradicar la infección. Estabilización en extensión con clavo cementado con cemento con doble antibiótico.
Factores que influyen en la forma de tratamiento de la infección de prótesis de rodilla.
Algunos factores del huésped (estado inmunológico, enfermedades inflamatorias de base, comorbilidades) o factores locales (presencia de fístulas, estado de las partes blandas), por su influencia en el resultado final, pueden condicionar nuestra forma de tratamiento de las infecciones de prótesis de rodilla.
Otros factores principales que pueden condicionar la forma de tratamiento de las infecciones de prótesis de rodilla son el tipo cronológico de infección, la identificación del microorganismo causal y la disponibilidad de terapias antibióticas efectivas, locales o sistémicas.
Tabla 1
Factores pronósticos / terapéuticos y (forma preferente de tratamiento).
➡️ F.Huésped: inmunosupresión, DM, malnutrición, corticoides, AR, artropatía psoriásica, lupus, trasplantados (TS Vs 2T).
➡️ Tipo infección
➡️ Precoz (DyR), subaguda (2T), tardía (DyR, 2T. 1T), hallazgo inesperado* (Ab), reinfección tras reimplantación (2T)
➡️ Duración de los síntomas, 4 semanas (2T)
➡️ Microorganismo causal, agresividad, identificación correcta (1T), hongos, polimicrobianas, enterobacterias (2T)…
➡️ Antibioticoterapia efectiva oral o iv (1 o 2 T)
➡️ Factores locales: estado de las partes blandas, fistulización (2 T, 1T posible), mecanismo extensor.
➡️ Factores médicos: apoyo multidisciplinar o no, grado de especialización (1T, 2T).
TS: Tratamiento supresor, 2T: Recambio en dos tiempos, 1T: Recambio en 1 tiempo, DyR: desbridamiento y retención, Ab: antibioticoterapia
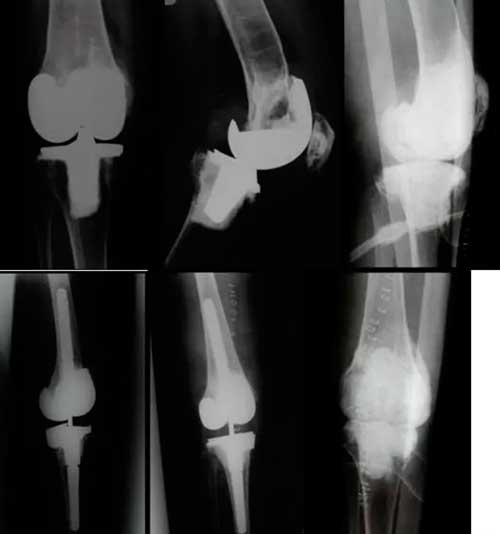
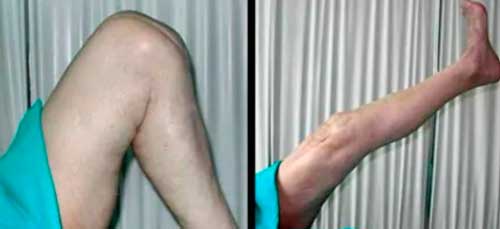
Paciente de 68 años con artritis reumatoide, inestabilidad y aflojamiento séptico de prótesis de rodilla. Defecto segmentario del fémur y de la tibia reconstruidos con espaciador manual con cemento con antibiótico. Alcanzó los 90º con el espaciador articulado. Tras un periodo de antibióticos intravenosos y orales, durante el cual la paciente caminaba con el espaciador articulado, se reimplantó con éxito una nueva prótesis con muy buen resultado clínico y funcional.
Precocidad del tratamiento médico y quirúrgico en el salvamento de prótesis infectadas de rodilla.
☑️ Patogenia de la infección de prótesis articular de rodilla
Trampuz y cols. clasifican las infecciones asociadas a prótesis articular como “precoces” (29-45%), que son las que aparecen en los tres primeros meses, “subagudas o de bajo grado” (23-41%) y “tardías” (30-33%), generalmente hematógenas.
La “infección post-quirúrgica precoz” es aquella que aparece dentro del primer mes post-operatorio. El diagnóstico clínico se basa en la existencia de fiebre, signos inflamatorios locales y supuración de la herida quirúrgica. Generalmente se producen por contaminación intraoperatoria y menos frecuentemente es debida a una metástasis hematógena desde un foco distante. El tratamiento incluirá el desbridamiento quirúrgico precoz con recambio del polietileno, retención de implantes y antibioticoterapia.
Un concepto importante es el del “drenaje prolongado de la herida quirúrgica”, que ha sido definido como: drenaje cuatro días consecutivos después del quinto día postoperatorio, drenaje que mancha un área de 2 por 2 cm y en el mismo sitio específico de la herida. Otros autores definen como drenaje prolongado aquel que persiste siete días tras la artroplastia. En algunos estudios se asocia a un 15-50% de infecciones profundas, dehiscencia o problemas de cicatrización por lo que su hallazgo es una alerta que obliga a realizar desdridamiento precoz con recambio del polietileno y toma de biopsias profundas.
La “infección post-quirúrgica tardía de la prótesis de rodilla” se corresponde con formas de inicio precoz no diagnosticadas o no tratadas antes de un mes. Son formas de aparición insidiosa entre el mes y los dos años después de la cirugía que se confunden con un problema inflamatorio o mecánico.
El dolor es el síntoma más consistente junto con el derrame, pero los signos flogóticos (calor, enrojecimiento…) son raros y no suele acompañarse de síntomas sistémicos de infección. El inóculo bacteriano es pequeño y parcheado por microorganismos de baja virulencia, con frecuencia estafilococos coagulasa negativos (SCN). Responden mal a la antibioticoterapia aislada por lo que hay que recambiar la prótesis, generalmente con un procedimiento en dos tiempos.
La “infección hematógena” representa el 0.1%-1% del total de infecciones. Puede presentarse de forma precoz, frecuentemente por un foco urinario o infección de catéter durante el postoperatorio, o a partir de los dos años de la artroplastia original, siendo esta indolora y con buena función hasta el momento de la infección tardía hematógena.
Entre estas, el 30% tienen un comienzo agudo y el 70% insidioso por una bacteriemia no diagnosticada, lo que puede condicionar la forma de tratamiento. En las formas de comienzo agudo el tratamiento primario será el desbridamiento con retención de implante y si fracasa o el microorganismo es muy virulento se optará por el recambio, en uno o en dos tiempos.
La “infección como hallazgo intraoperatorio o cultivos positivos” en el caso de cirugía de revisión que se presumía aséptica suele responder bien a la antibioticoterapia aislada.
En aquellos casos de “reinfección tras reimplantación” la reimplantación en dos tiempos de la prótesis de rodilla se considera el tratamiento de elección. Generalmente los fracasos reaparecen antes de 2 años y se necesitan múltiples intervenciones para erradicar la infección.
Un porcentaje elevado acaba en terapias de salvamento: fusión 40%, amputación 20% o tratamiento supresor de la infección de prótesis de rodilla.
Las condiciones del huésped, microorganismo causal, de las partes blandas y del mecanismo extensor determinarán que hagamos o no un tratamiento de salvamento (artroplastia resección…), pero en general se considera que la reimplantación es mejor que otros procedimientos.
Drenaje prolongado de herida quirúrgica de prótesis de cadera. En estos casos una actitud más agresiva, con desbridamiento y toma de muestras protocolizadas, puede prevenir el desarrollo de una infección crónica y evitar el enmascaramiento de una infección en curso.
☑️ Tiempo de evolución de los síntomas.
Respecto al tiempo de evolución de los síntomas, algunos autores consideran que los resultados con el desbridamiento y retención de implantes, mejoran si se realiza antes de cuatro semanas, otros si se hace antes de una semana. Brandt y cols, en el tratamiento con desbridamiento y retención de implantes en infecciones por S. aureus obtenían diferencias significativas cuando el desbridamiento se realizaba en las primeras 48 horas aunque tenían un 70% de fallos a los dos años. Deirmengian y col no obtuvieron diferencias significativas en una serie de 31 casos con un 92% de fracasos. En estos trabajos no se aplicaba terapia combinada antibiótica con rifampicina, sino pautas IV de 4-6 semanas, lo que podría representar una limitación terapeútica para evitar la formación de biopelículas. Obviamente en una infección subaguda la evolución de los síntomas siempre será superior al límite de un mes, postulado por algunos autores, para considerarlo como tratamiento precoz. Del trabajo de Trampuz y cols. se desprende que en la mayoría de las infecciones hematógenas tardías la evolución clínica es insidiosa, no aguda, limitando la opción del desbridamiento precoz con retención de implantes por lo que, en función del tipo de microorganismo, pueden considerarse el recambio en uno o en dos tiempos.
Disponibilidad de terapias antibióticas combinadas orales en el salvamento de prótesis de rodilla infectadas.
La rifampicina es el único agente con actividad bactericida comprobada frente a las formas sesiles de estafilococos, aquellos creadores de biopelícula que tienen una actividad y crecimiento lentos. Ha demostrado su actividad in vitro, in vivo y en modelos experimentales frente a microorganismos creadores de escudos.
Sin embargo, su uso como antibiótico aislado induce la aparición temprana de resistencias en estafilococos en 24 horas, por lo que el éxito de estos tratamientos es más probable cuando se combinan con glicopéptidos o quinolonas, estas últimas con excelente biodisponibilidad, actividad bactericida y tolerabilidad, o con otros agentes como el trimetoprim-sulfametoxazol, la minociclina y el linezolid.
Se aconsejan pautas de tres a seis meses con combinación de rifampicina y una quinolona, generalmente el levofloxacino porque tiene efecto bactericida frente a SCN en fase no duplicativa y en ausencia de síntesis proteica, lo que podría traducirse en una mayor actividad frente a bacterias contenidas en una biopelícula.
En el estudio prospectivo randomizado de Zimmerli la tasa de curación de los tratados con rifampicina por infección estafilococica fue del 100%, frente al 58% del grupo placebo.
La agresividad del microorganismo causal en el salvamento de prótesis de rodilla infectada.
La presencia de E. coli, Pseudomonas aeruginosa, enterobacterias o infecciones polimicrobianas se asocia a peores resultados en los trabajos con reimplantación en un tiempo, por lo que podrían ser una contraindicación relativa para la retención de implantes o para el recambio en un tiempo.
Por el contrario SCN y S. aureus tiene mejor respuesta. En el caso de infección precoz por estafilococo es posible, el éxito de la terapia combinada con retención de implantes que de otra forma conllevaría resultados uniformemente malos. En las subagudas y tardías es posible el recambio en un tiempo siguiendo los principios de esta forma de tratamiento y de las terapias combinadas para evitar la persistencia de la infección.
La elevada tasa de recidiva observada en la infección sobre un implante ortopédico a pesar de un tratamiento muy prolongado, es debido a la capacidad de los microorganismos de crecer sobre la superficie inerte del implante formando una biopelícula.
Las bacterias que se encuentran en los estratos más profundos de la biopelícula presentan elevada resistencia a antisépticos y antibióticos debido a las condiciones metabólicas (escasez de oxígeno y nutrientes) que existen en ese medio, por lo que la bacteria se adapta reduciendo su metabolismo y su tasa de duplicación.
Si reproducimos en el laboratorio estas condiciones de mínima actividad metabólica, la eficacia del antibiótico desciende considerablemente. Esto se explica por el aumento espectacular de la “concentración mínima inhibitoria” (CMI) del antibiótico frente a ese microorganismo, que en condiciones óptimas de crecimiento seria sensible.
La CMI representa la concentración bactericida en condiciones de laboratorio pero “in vivo” la concentración de antibiótico necesaria es mucho más elevada, “concentración mínima bactericida” (CMB) y esta no puede alcanzarse con las dosis habitualmente utilizadas en la clínica por lo que el tratamiento fracasa si no se retira el implante.
Algunos autores creen que la diferencia entre la infección aguda o tardía podría estar en la madurez y extensión del escudo o biocapa en función del tiempo de evolución, poniendo de manifiesto una vez más la importancia del concepto de la “carrera por la superficie del implante”.
La posibilidad de determinar estas concentraciones o modificar la actividad de las bacterias de la biopelícula, reduciendo la CMB, podría ser el factor crítico para identificar las infecciones susceptibles de curación en estas formas bacterianas de bajo crecimiento.
Estudios realizados “in-vitro” demuestran que la aplicación de ultrasonidos (US) sobre una superficie colonizada por una biopelicula potencia la acción del antibiótico al aumentar el transporte del antibiótico a través de la biopelícula y de la membrana bacteriana.
Algunos estudios en modelos experimentales de infección sobre cuerpo extraño, han puesto de manifiesto que la aplicación de US de baja frecuencia (1MHz) e intensidad (< 2 W/cm2) y un antibiótico por vía sistémica es una combinación sinérgica para erradicar una biopelícula. Este fenómeno se ha denominado “efecto bioacústico”. Gracias a él, aumenta la permeabilidad de membranas biológicas y por tanto la difusión de oxígeno y nutrientes a los estratos profundos de la biopelícula, lo que supondría la activación del metabolismo bacteriano, aumentando su susceptibilidad a los antibióticos.
Estos efectos se han demostrado sobre S. epidermidis, E. coli y P. aeruginosa; estudios futuros deben confirmar estos hechos en la práctica clínica pudiendo modificar lasindicaciones de tratamiento en un tiempo.
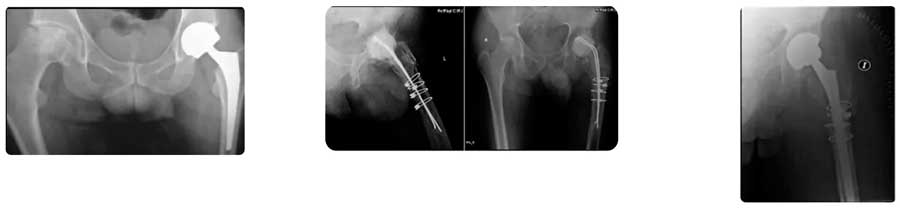
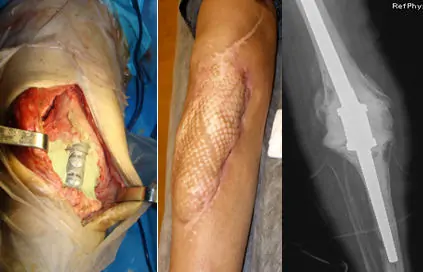
Varón de 55 años. Acude consulta con prótesis infectada implantada unos meses antes por una necrosis avascular. El paciente refería que, durante el postoperatorio la herida estuvo manchando mucho tiempo, cuadro compatible con “drenaje prolongado”. Se trató con antibióticos orales, sin hacer desbridamiento y toma de muestras protocolizadas y se cerró hasta meses más tarde en que se fistulizó. Se corresponde a una infección subaguda. No se puede descartar que se enmascarase una infección aguda con los antibióticos aislados sin haber desbridado y tomado cultivos protocolizados. En estos casos el criterio más exitoso es realizar una revisión de la prótesis en dos tiempos quirúrgicos colocando un espaciador de cemento cargado de antibióticos. En el primer tiempo quirúrgico fue necesaria una osteotomía del trocánter mayor por la excelente fijación del vástago empleado. En las muestras protocolizadas se aisló un Stafilococo Aureus Resistente a Meticilina. Tras un periodo de antibióticos IV y orales específicos los reactantes de infección se normalizaron y el paciente fue reimplantado con éxito con un vástago Wagner y un cotilo poroso atornillado.
Conclusiones sobre el salvamento, fusión y amputación en las prótesis de rodilla infectadas.
✅ Los factores del huésped, las características del microorganismo, el tipo cronológico de infección y el grado de especialización del equipo médico-quirúrgico pueden condicionar nuestra forma de tratamiento y nuestras posibilidades de éxito.
✅ La identificación correcta del microorganismo causal y la disponibilidad de combinaciones locales y sistémicas efectivas de antibiótico pueden condicionar nuestra elección de recambio en uno o en dos tiempos.
✅ Las infecciones precoces o las tardías de comienzo agudo deben ser tratadas con desbridamiento y retención de implantes o con el recambio en un tiempo. La terapia combinada con rifampicina, como medio de evitar resistencias, ha elevado las tasas de curación en la infección precoz tratada con desbridamiento, recambio del polietileno y antibioticoterapia prolongada desde el 10%-50% hasta el 80%-90%.
✅ El recambio en dos tiempos es el tratamiento de elección en las infecciones tardías o subagudas. Sus resultados son consistentes con independencia de las modificaciones en la técnica o de la concentración de antibiótico alcanzada en los espaciadores de cemento.
✅ El desarrollo de nuevos antibióticos con mayor actividad y concentración en los tejidos, la posibilidad de determinar la concentración mínima bactericida o de modificar la actividad de las bacterias de la biopelícula mediante la aplicación de ultrasonidos podría contribuir a ganar la “carrera por la superficie del implante”, ayudarnos a identificar las infecciones susceptibles de tratamiento con éxito y optar por el procedimiento quirúrgico más rápido y menos agresivo.
Casos clínicos de salvamento, fusión y amputación en las prótesis de rodilla infectadas.
Caso 1.
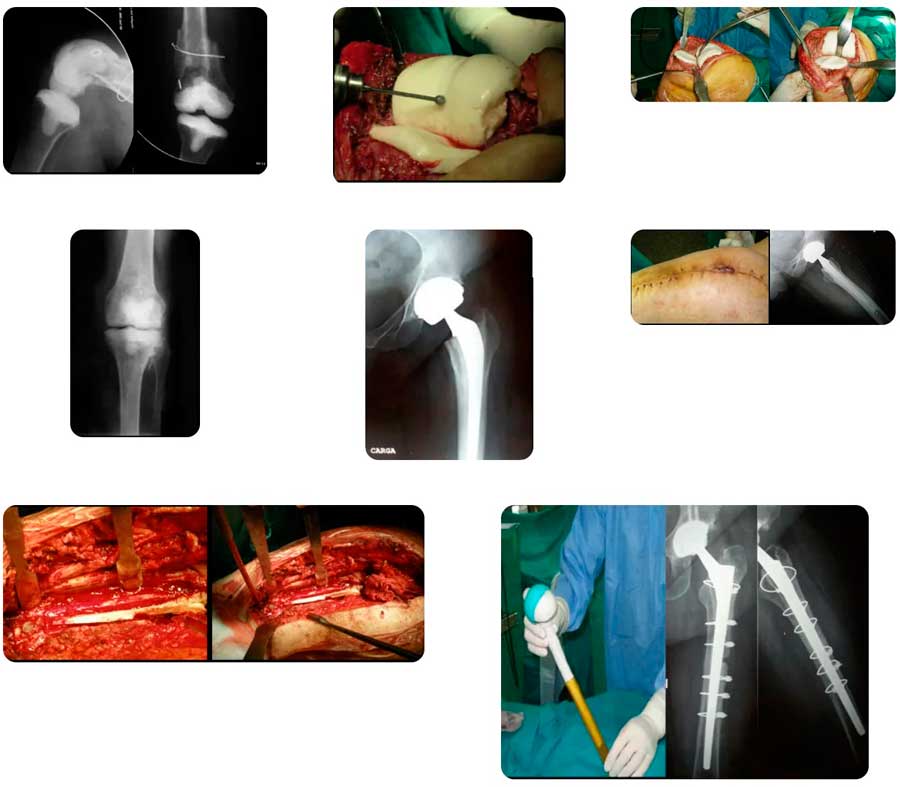
Mujer 65 años, artritis reumatoide, PTR infectada y fistulizada. Defecto segmentario, requirió varios recambios de espaciador por roturas y persistencia de la infección. Mantuvo la movilidad de la rodilla y un mecanismo extensor competente con los espaciadores por lo que, finalmente, se pudo reimplantar con una prótesis de bisagra rotaciona con buen resultado clínico y funcional. La paciente mantenía su independencia para caminar y sus actividades de la vida diaria.
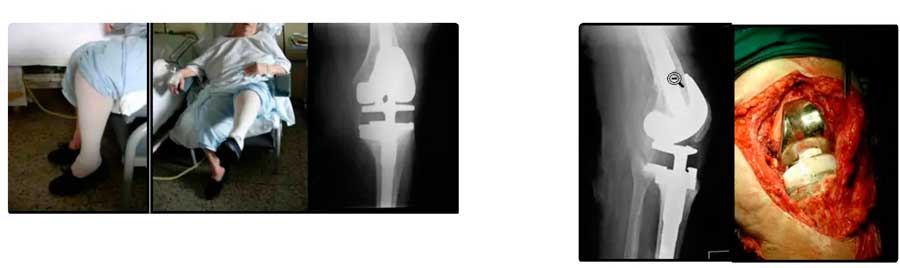
Caso 2.
Varón 57 años con prótesis total de cadera híbrida, vástago Versys cementado y cotilo Durom metal-metal. En el postoperatorio inmediato tuvo un cuadro de drenaje prolongado de la herida quirúrgica que requirió varios desbridamientos pero los cultivos no fueron concluyentes y la Proteína C Reactiva y la Velocidad de Sedimentación estaban en límites normales. Finalmente se realizó un recambio completo en dos tiempos. La extracción de la prótesis, del cemento, el desbridamiento exhaustivo de todo el tejido necrótico y la toma de muestras protocolizdas son la clave del éxito en la primera etapa del recambio en dos tiempos. El espaciador largo conformado manualmente y sobrepasando la zona de osteotomía del trocánter se cargó con dos antibióticos al 10% del peso total. La sonicación del implante retirado (desprendimiento de las membranas de tejido que lo rodean mediante ultrasonido) y el cultivo posterior fue positivo para Staf. Coagulasa Negativo Resistente a Meticilina. El paciente fue dado de alta y tras un periodo de antibióticos (Daptomicina) intravenoso fue reimplantado con éxito utilizando un vástago Wagner.
Vídeo: Operación de prótesis de rodilla fracasada.
Vídeo: Las complicaciones de las prótesis de rodilla.
Artículo escrito y verificado por el especialista en traumatología Dr. Villanueva.
Gracias por compartir: